Afgelopen jaar werd de Nobelprijs voor scheikunde toegekend aan drie chemici voor hun innovatieve onderzoek naar de ruimtelijke structuur van eiwitten en het gebruik van AI om deze structuren te voorspellen en te ontwerpen. Tijd dus om een historisch licht te laten schijnen over de route, langs vele andere Nobellaureaten, naar onze hedendaagse kennis van deze cruciale bouwstenen van het leven.
Het verhaal van de proteïnen start rond 1750 als Duits-Poolse scheikundige en arts Caspar Neumann het wit van kippenei — albumen — bestudeert. Enkele decennia later komt de Franse graaf Antoine de Fourcroy, ook scheikundige, met de naam albumine. Maar nog iets eerder, in 1728, onderzoekt de Italiaanse scheikundige Jacobo Beccari tarwebloem en vindt naast een op planten gelijkende fractie, amylaceum, ook een diergelijkende kleefstof, die hij glutine noemt. Weer iets later, rond 1760, vindt de Zweedse chemicus Carl Scheele die stof in diverse gewassen en in 1773 toont zijn Franse vakgenoot Hilaire Rouelle deze component aan in het sap van groene planten.
En zo gaat het nog even door. De Duitse landbouwscheikundige Heinrich Einhof onderzoekt ook tarwebloem en vindt hierin begin 1800 een wateronoplosbare fractie die hij eerst dierlijk-vegetale materie, later plantenglobuline doopt. Volgens Henri Braconnot, Frans chemicus en apotheker, is legumine hiervoor een beter woord (1827), terwijl de Duitse chemiepionier Justus von Liebig het liever over plantencaseïne heeft (1841). Wat de naam ook is, de aangetroffen fase wordt later nog verder gefractioneerd door de Duitse landbouwchemicus Karl Ritthausen en de Amerikaan Thomas Burr Osborne, tevens de bedenker van de amide- of peptidebinding.
‘Berzelius stelt de naam “proteïne” voor’
Weer een klein sprongetje terug in de tijd, want in 1819 onderzoekt de Italiaan G. Taddei het gedrag van deze tarwekleefstof in alcohol: het oplosbare deel noemt hij gliadine, het onoplosbare deel zymom. Jöns Jacob Berzelius, Zweeds chemicus, stelt ze gelijk aan respectievelijk plantenlijm en planteneiwit (1828). Om de verwarring compleet te maken bedenkt de eerdergenoemde Osborne voor deze laatste de naam prolamine of glutinine. Wie kan het nog volgen? Wanneer en hoe de omvattende naam proteïne op het toneel verschijnt vernemen we zo dadelijk.
Gemeenschappelijke elementen
Reeds rond 1790 vermoedt de Duitse chemieprofessor Friedrich Gren dat alle eiwitten opgebouwd zijn met één enkele ‘oereiwitstof’, bestaande uit de elementen C, H, N, O, P en kalkaarde. Het Franse duo Louis Gay-Lussac en Louis-Jacques Thénard onderwerpen o.a. fibrine, ei-albumine, caseïne en gelatine aan kwalitatieve elementanalyse. Hun landgenoot Jean-Baptiste Boussingault, landbouwscheikundige, poneert in 1836 dat de elementsamenstelling van tarwekleefstof en ei-albumine dezelfde is. Maar het is de Nederlandse chemicus, arts en politicus Gerrit Jan Mulder die door zijn kwantitatieve verbrandingsanalyses (1836-1838) aantoont dat alle eiwitten een gemeenschappelijk basisbestanddeel hebben (C40H62N10012, vaak gecombineerd met één atoom zwavel) dat hij, op voorstel van Berzelius, ‘proteïne’ noemt. De term is afgeleid van het Griekse protheo dat ‘vooraan lopen’ betekent. Gaandeweg zal deze term alle eiwitten omvatten.
[Lees verder onder de afbeelding]
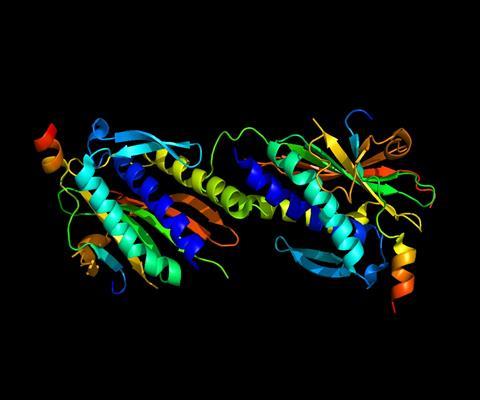
Nieuwe pogingen om een gemeenschappelijk principe voor eiwitten aan te wijzen komen van de Franse apotheker Apollinaire Bouchardat in 1842 met zijn idee van albuminosen — brokstukken na mildzure hydrolyse van fibrine, albumine en gluten; van de Duitse biochemicus Albrecht Kossel die wijst op gemeenschappelijke structuren van peptonen en albuminosen; maar vooral van de Praagse proteïnechemicus Franz Hofmeister. In 1902 poneert hij de aminozuren, met amide-achtige binding. Het experimentele bewijs voor deze binding komt in 1908 van de Duitse scheikundige en Nobelprijswinnaar Emil Fischer. Hij synthetiseert tevens enkele korte aminozuurketens, tot 18 eenheden, die hij de term (poly-)peptiden meegeeft, naar analogie met de polysachariden. Later zal de Amerikaanse wetenschappelijke duizendpoot Linus Pauling bewijzen dat de amidebinding in één vlak ligt.
In 1943 kunnen de Britten Richard Synge en Archer Martin, gedeelde Nobelprijs voor scheikunde in 1952, dankzij de papierchromatografie de karakteristieke plaats van enkele aminozuren en peptiden identificeren. De volgorde van de aminozuren wordt door hun landgenoot Frederick Sanger, zelf tweevoudig Nobelprijswinnaar, rond 1950 onthuld dankzij zijn reagens 1-fluoro-2,4-dinitrobenzeen. De Zweed Pehr Edman komt met isothiocyanaat als aangepast reagens. De synthese van vele polypeptiden komt pas goed op dreef na 1950, waaronder bijvoorbeeld de volledige synthese van insuline door de Amerikaanse biochemicus Panayotis Katsoyannis in 1963.
‘Later zal de Amerikaanse wetenschappelijke duizendpoot Linus Pauling bewijzen dat de amidebinding in één vlak ligt’
Schroeven en platen
De volgorde van de aminozuren in de aminozuurketen, de ‘ruggengraat’ van een eiwit, wordt de primaire structuur genoemd. Maar hoe gedragen deze ketens zich in de ruimte? Dit is het favoriete onderzoeksveld van Linus Pauling. Hij doet hiervoor een beroep op de röntgenstralendiffractie, ook aangewend voor zijn eerste studieopdracht in 1922 waardoor hij de afstanden en hoeken in kristalroosters van o.a. MoS2 en WS2 kan meten en interpreteren. Met soortgelijke gegevens zal hij later zijn beroemde schaalmodellen van eiwitten bouwen. Deze RX-techniek was toen echter nog niet van toepassing op organische producten, waarin vooral waterstof te klein is om de stralen voldoende te breken. Maar eiwitten zijn veel ingewikkelder dan de triatomaire moleculen.
Vanaf 1935 stort Pauling zich op de studie van het magnetisme van hemoglobine, meer dan een eeuw eerder reeds waargenomen door de beroemde Michael Faraday. Hierdoor komen Pauling en zijn assistent Robert Corey in 1948 op de formulering van de alfa-helix, een schroefvormige zone in het eiwitmolecule met rechtse spoed en een oneven aantal aminozuren per spoed. Niet veel later stuiten ze op op de bèta-plaat of bèta-sheet, een vlakke zone elders in datzelfde eiwitmolecule. Beide configuraties vormen de zogeheten secundaire structuur van het eiwit. Pauling ontvangt in 1954 de Nobelprijs voor de Scheikunde voor zijn werk aan de aard van de chemische binding en hoe dat is toe te passen bij het ophelderen van de structuur van complexe verbindingen.
Waterstof- en zwavelbruggen
De schroef, ofwel de alfa-helix, komt tot stand door waterstofbruggen tussen de O van -CO- en een verder gelegen H van -NH- in de ruggengraat. De zijketens komen dan aan de buitenkant van de spiraal te liggen en kunnen interageren met het oplosmiddel, bijvoorbeeld door waterstofbruggen te vormen met watermoleculen, hetgeen de oplosbaarheid van dat eiwit bepaalt. In de bèta-plaat is de ruggengraat uitgestrekt zodat de opeenvolgende zijketens afwisselend boven en onder het vlak uitkomen en een wisselwerking via waterstofbruggen kan ontstaan met naastgelegen polypeptidesegmenten. Naburige zijketens die enkel H en C atomen bevatten creëren onderling de hydrofobe interactie. Ook zwavelbruggen tussen cysteïnemoleculen van de polypeptide draagt bij tot de stabiliteit en conformatie. Dat kunnen vezels zijn, met een structurele functie zoals in keratine, collageen, myosine en fibrine, of kluwens met metabole functie, zoals enzymen, globulinen of sommige hormonen. Tenslotte veroorzaken geladen aminozuren een elektrostatische binding tussen ver uit elkaar gelegen delen van de keten.
[Lees verder onder de afbeelding]
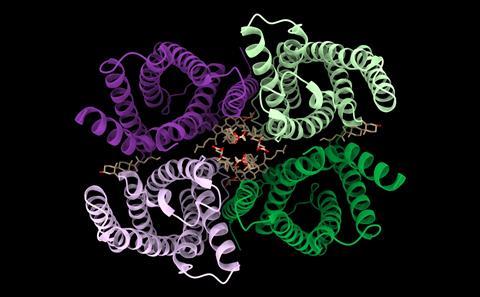
Deze vier bindingstypes vormen, na de primaire en secundaire daarom de tertiaire structuur. Indien één of enkele aminozuren ontbreken of op een andere plaats staan in de ruggengraat verandert dus de vouwing van het geheel en verdwijnt of wijzigt de functionaliteit van het eiwit, wat zogeheten allostere enzymen aantonen. Tot slot is er nog de quaternaire structuur van eiwitten. Dit betreft de vorming van grotere, complexere structuren waarin meerdere proteïnestrengen met elkaar zijn verbonden. Een bekend voorbeeld is de heemgroep in hemoglobine. Voor het ophelderen van deze structuur kregen Max Perutz en John Kendrew de Nobelprijs in 1962.
‘Zijn we met AI op weg naar een “quintenaire” structuur van eiwitten?’
De 5e dimensie?
Met inmiddels vier structuurniveaus geïdentificeerd rijst de vraag of we nu op weg zijn naar een ‘quintenaire’ structuur van eiwitten. Zorgt de artificiële intelligentie van de drie meest recente chemische Nobelprijswinnaars, David Baker, Demis Hassabis en John Jumper, voor een superstructuur of voor onverwachte combinaties met andersoortige stoffen? Of voor slimme, eventueel synthetische eiwitten die informatie kunnen opslaan, combineren, evalueren en zelfs beredeneren en delen? Treedt AI dan in de plaats van DNA en zullen we synthetische ribosomen maken? Of is dit een te verre blik in de toekomst?















Nog geen opmerkingen