Fluorescerende eiwitten en biosensoren zijn niet meer weg te denken uit biologisch onderzoek. Naast kleur en intensiteit, richten onderzoek van de Universiteit van Amsterdam zich nu op de levensduur als interessante parameter. ‘Die is alleen afhankelijk van de chemie van de chromoforen.’
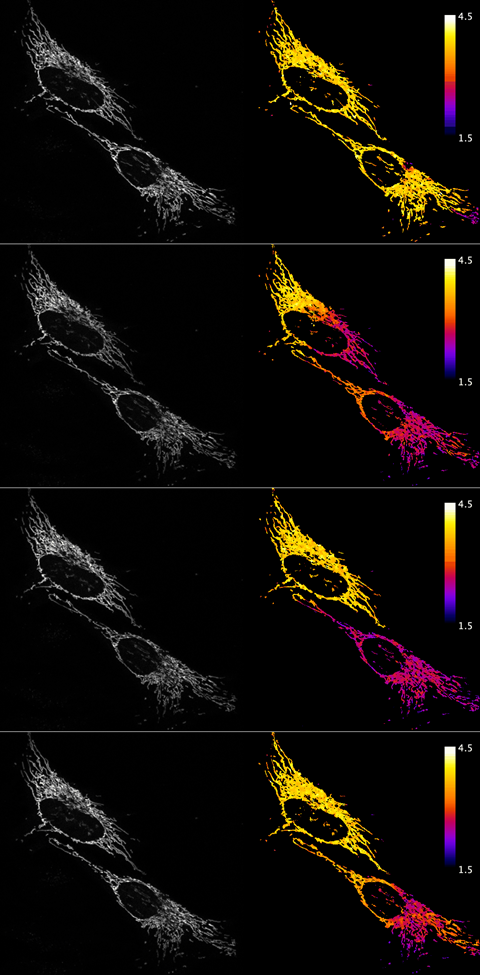
Op het scherm zijn, schuin boven elkaar, twee geel gekleurde cellen te zien. Opeens trekt er vanaf rechtsonder een roodpaarse golf door de cellen. Het is het effect van een zeepje dat Joachim Goedhart toedient zodat al het calcium vanuit het medium in de mitochondriën komt. Dat effect nemen we waar dankzij een nieuwe calcium biosensor. Een sensor die opvallend genoeg niet de intensiteit van de fluorescentie meet, maar de levensduur van de fluorofoor. Maar daarover straks meer.
Het gebruik van fluorescente eiwitten en biosensoren is steeds meer vanzelfsprekend. Niet alleen om te kunnen zien waar een bepaald eiwit zit, maar ook om te onderzoeken wat het doet. Het ontwikkelen van deze gereedschappen is een vakgebied apart, waarbij kennis, expertise en geluk allemaal een rol spelen. Sinds de ontdekking van het groen fluorescerend eiwit (GFP) hebben onderzoekers veel geleerd. Over welke aanpassingen het eiwit helderder of in een andere kleur te laten fluoresceren, en hoe het eiwit te koppelen aan een biosensor. ‘Maar ik vind eigenlijk dat we nog verrassend weinig inzicht hebben over hoe die dingen zich precies fluorescent maken’ zegt Dorus Gadella, hoogleraar moleculaire cytologie aan de Universiteit van Amsterdam. In zijn groep ontwikkelen ze nieuwe fluorescerende eiwitten en biosensoren.
Met behulp van mutaties brengen ze veranderingen aan op plekken waarvan ze weten of vermoeden dat het de fluorescentie beïnvloedt, waarna ze screenen op gewenste uitkomsten. ‘Waar je uiteindelijk terechtkomt hangt af van welke screeningsmethodes je daarvoor gebruikt’, zegt universitair docent moleculaire cytologie Joachim Goedhart. ‘Je kan op kleurvarianten gaan screenen, of fotostabiliteit. En een van de originele toevoegingen van ons laboratorium is dat we zijn gaan kijken naar de levensduur.’
’We hebben nog verrassend weinig inzicht over hoe die dingen zich precies fluorescent maken’
Dorus Gadella
Trillen
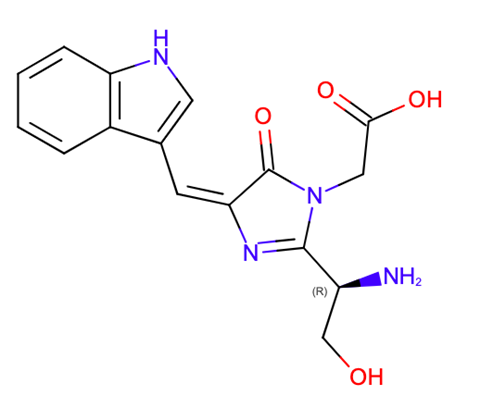
Gadella legt het uit aan de hand van een 3D geprint model van mTurquoise2, een blauw fluorescent eiwit afkomstig uit een bioluminescerende kwal. De bron van de fluorescentie is een een fluorofoor die bestaat uit drie aminozuren: serine, tryptofaan en glycine. Daaromheen zit de rest van het eiwit gevouwen, als een zogeheten barrel. Deze ‘ton’ bestaat uit bèta-sheets en houdt de fluorofoor op z’n plek. Door het absorberen van fotonen van een bepaalde golflengte gaan de elektronen in de fluorofoor trillen. Daardoor wordt het contact met de omringende barrel verbroken. De opgenomen energie kan de fluorofoor vervolgens weer loslaten door fotonen van iets lagere energie uit te zenden, of door om te klappen.
‘Aan die nieuwe uiteinden kun je eigenlijk allerlei dingen vastplakken of er aanzetten’
Joachim Goedhart
‘En wat wij doen met levensduur, is kijken naar hoe lang die fluorofoor in staat is om die aangeslagen energie vast te houden, voordat die gaat fluoresceren. Dat is voor een fluorescent eiwit een vast getal. Alleen afhankelijk van de chemie van de chromoforen’ zegt Gadella. Dat maakt het onafhankelijk van de microscopie opstelling. Dit in tegenstelling tot de fluorescentie-intensiteit, die onderzoekers meestal gebruiken. Die intensiteit is namelijk ook afhankelijk van het aantal moleculen, de gebruikte laser en de kwaliteit van de detector.
Verbouwing
Tot zo ver de fluorescerende eiwitten. Voor biosensoren verbouwt Goedhart het fluorescerende eiwit flink. Hij knoopt de originele uiteinden van het eiwit aan elkaar en maakt twee nieuwe uiteinden in de barrel vlak bij het punt dat de fluorofoor op z’n plaats houdt. Die nieuwe uiteinden zijn de essentie van fluorescerende biosensoren. ‘Aan die nieuwe uiteinden kun je eigenlijk allerlei dingen vastplakken of er aanzetten’ zegt Goedhart. Voor een calcium sensor zijn dit twee domeinen die meer aan elkaar plakken bij toenemende calcium concentraties. Door die interactie verschuift de barrel iets en houdt zo de fluorofoor meer of juist minder op z’n plek.

‘Dit is heel vaak gedaan met GFP en wij wilden dus graag kijken of je ook in plaats van gewoon een intensiteitsverandering een levensduur verandering kan bewerkstelligen, omdat die zo robuust is’, zegt Goedhart. Dit resulteerde in de, samen met de inmiddels gepromoveerde Franka van der Linden ontwikkelde, turquoise en groene Ca-FLITS biosensoren. Met als voordeel dat de levensduur van de Ca-FLITS biosensoren één-op-één correleert met de calcium concentratie. Onderzoekers hoeven daarom niet meer elke keer als ze de sensor gebruiken eindeloos te kalibreren.
‘Je ziet echt wat er gebeurt, gewoon met je ogen’
Jaap van Buul
Bloedvatwand
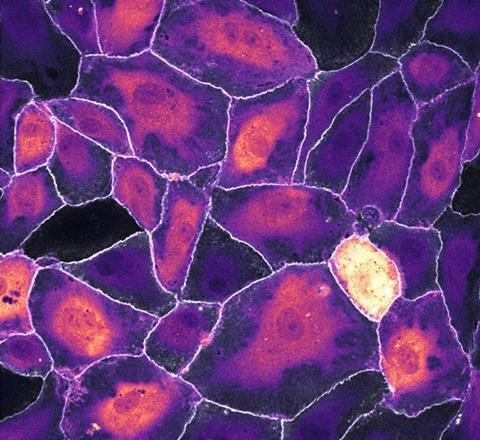
Tijdens de ontwikkeling van nieuwe biosensoren en fluorescente eiwitten gebruikt de groep van Gadella versimpelde systemen, die goed te screenen en gebruiken zijn. ‘Dus je hebt een heel simpel celsysteem, wat eigenlijk niet zoveel met de biologie heeft te maken’, zegt Jaap van Buul, hoogleraar vasculaire celbiologie aan de Universiteit van Amsterdam. ‘Maar de moeilijkheid is juist soms om er een mooi biologisch systeem bij te vinden. Dat is dan ook waar wij om de hoek komen.’ Hij onderzoekt hoe leukocyten een infectie aan de buitenkant van een bloedvatwand weten te vinden, om precies daar door de bloedvatwand heen te kruipen. Daarbij werkt hij veel samen met de moleculaire cytologie-groep. Het voordeel van de probes is volgens Van Buul ‘dat je echt kan zien wat er gebeurt, gewoon met je ogen.’
Een van de biosensoren die Van Buul gebruikt laat heel lokaal in de cel eiwitactivatie zien. ‘Dan kunnen we bijvoorbeeld zien dat alleen op een bepaalde plek het eiwit actief wordt, en niet ergens anders. En dan blijkt dat daar ook de leukocyt doorheen gaat.’ Voor Van Buul is de samenwerking met de moleculaire cytologie-groep inmiddels onmisbaar en ook Gadella en Goedhart halen er de motivatie uit om aan die moleculen te blijven sleutelen om ze steeds beter en helderder te krijgen. Binnenkort gaat Werner van der Meer, promovendus bij Van Buul, aan de slag met de nieuwe Ca-FLITS biosensor. Met als doel: nagaan of er een lokaal calcium signaal is dat correspondeert met de plaats waar de leukocyt door de bloedvatwand heengaat. Voor Gadella en Goedhart de test of Ca-FLITS daadwerkelijke nieuwe inzichten geeft in een complex biologisch systeem.



















Nog geen opmerkingen