Kankercellen laten een bepaald celcyclus-programma te hard aan staan, waardoor de cellen DNA-schade veelal negeren. Dat verklaart waarschijnlijk waarom sommige patiënten niet goed op chemo- en stralingstherapieën reageren, staat in Cell Reports.
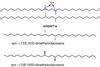
De cyclus van celdeling is een complexe gebeurtenis. Een van de hoofdpaden die zorgt voor het verdubbelen van het genetische materiaal vlak voor de celdeling wordt aangestuurd door de E2F-genen. Deze genen coderen voor de nodige transcriptiefactoren die weer bestaan uit twee groepen, de activators (E2F1-3a) die het kopiëren van DNA starten en de suppressors (E2F3b-8) die dat proces weer stoppen.
In kankercellen is dat proces verstoord: de E2F-genen zijn veel meer tot expressie gebracht en zorgen dat de celdeling te snel wordt ingezet. Jet Segeren, Bart Westendorp en collega’s van de Universiteit Utrecht vonden dat dat niet alleen zorgt voor ongecontroleerde celdeling, maar dat de cellen ook niet meer kunnen ontsnappen uit de celcyclus. Het gevolg is dat kankercellen ondanks DNA-schade blijven doordelen. De schade wordt niet volledig opgeruimd, en zo zouden nieuwe mutaties kunnen ontstaan.
Normale cellen, dus zonder mutaties, activeren namelijk het APC/CCdh1-complex om uit de celcyclus te stappen wanneer er sprake is van DNA-schade. Maar bij een hoge concentratie van het E2F3-activatorgen in de gemuteerde cellen lukt dat niet. Daardoor krijg je cellen die ongeremd gaan delen met beschadigd DNA, wat uiteindelijk kanker tot gevolg heeft.
Dat DNA-schade dus eigenlijk maar weinig invloed uitoefent op het stopzetten van de kankerceldeling is een belangrijke observatie. Normaal gebruik je namelijk radio- of chemotherapie om kanker te behandelen. Die strategieën zijn erop gericht om de kankercellen te dwingen om te stoppen met delen door ze genetische schade toe te brengen. Maar als die invloed dus eigenlijk gering is, moet je op zoek naar andere methodes.
Westendorp laat weten dat na proeven met standaard chemotherapie inderdaad resistentie optreedt bij kankercellen met een verhoogd E2F-niveau. Maar hij en zijn team werken ook al aan een oplossing. ‘We hebben allerlei ideeën over hoe we dit E2F-afhankelijke resistentiemechanisme zouden kunnen blokkeren, dus hopelijk kunnen we in de aankomende jaren nieuwe combinatietherapieën gaan ontwikkelen om betere behandeling aan patiënten te kunnen bieden’, vertelt Westendorp.
Segeren, H. et al. (2020) Cell Reports 33(108449)













Nog geen opmerkingen