Single-cell technieken bieden veel mogelijkheden, maar het is lastig om ook binnenin organen alle cellen te bereiken. Onderzoekers van MIT komen nu met een nieuwe aanpak, waarmee ook die moeilijk bereikbare delen glorieus in beeld komen.
De ontwikkeling van single-cell technologieën heeft veel nieuwe inzichten opgeleverd over de heterogeniteit van cellen binnen weefsels en organen. Dankzij deze mogelijkheden voor het sorteren, tellen, sequencen en visualiseren van inviduele cellen zijn geheel nieuwe kwantitatieve analyses mogelijk van complexe biologische processen, van cellulaire populaties en van de ruimtelijke context waarbinnen tal van processen plaatsvinden.
Deze technieken vereisen echter meerdere stappen waarin de cellen worden gefixeerd, gelabeld en gewassen. Om betrouwbare, kwantitatief relevante metingen te verrichten is het natuurlijk cruciaal dat alle cellen in gelijke mate worden voorbewerkt en behandeld. Dat gaat prima voor losse cellen (1D) of voor heel dunne plakjes weefsel (2D), maar het beperkt de mogelijkheden om complete, intacte organen of weefsels op singe-cell niveau te analyseren. Daar brengen onderzoekers van The Picower Institute van MIT nu verandering in met een nieuwe 3D-aanpak waarmee ze alle cellen in complete organen weten te labellen.

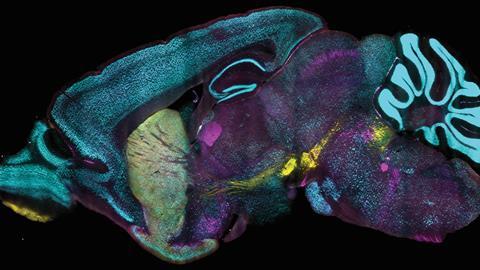
Single-cell imaging in intacte muizenhersenen. Gelabelde eiwitten laten verschillende celtypen in een intact muizenbrein zien: neuronen (cyaan) die overal zichtbaar zijn en verder cellen die specifiek zijn voor de neurotransmitters dopamine (geel) en acetylcholine (magenta).
Source: Chung Lab/MIT Picower Institute
Een van de moeilijkheden bij het behandelen van organen is dat de antilichamen die je gebruikt voor de labeling slechts moeizaam doordringen tot de cellen in de binnenste, compacte regionen. Onderzoeksleider Kwanghun Chung vergelijkt het met het marineren van vlees. ’Als je een stuk vlees gewoon in de marinade legt, zullen de buitenste lagen snel de marinade opnemen, maar binnenin verandert er niets. Voor cellen in een dichtgepakt weefsel geldt hetzelfde, maar dat verstoort wel je meting. Langer marineren helpt, maar dat maakt het labelen van complete organen een heel tijdrovend proces.’
Daarbij komt dat de chemicaliën die je kunt gebruiken om de binnenste lagen van weefsels te bereiken dusdanig agressief zijn, dat je de integriteit van de cellen verstoort, waardoor je ook geen goede meting van een intact orgaan kunt doen. Voortbouwend op eerdere technieken uit het Chung-lab, zoals CLARITY, SHIELD en SWITCH, komt het team nu met CuRVE, waarmee ze in staat zijn om — zoals hier op de foto —3D single-cell imaging te doen op een intact muizenbrein.
De clou zit in het spelen met de zogeheten speed mismatch: de discrepantie tussen het langzame tempo waarin antilichamen door weefsels bewegen en de snelheid waarmee ze aan hun target binden en dus vooral aan de cellen in de buitenste laag blijven plakken. Door de bindingscapaciteit van de antilichamen gecontroleerd uit- en weer aan te schakelen met behulp van deoxycholzuur (dat na uitgebreide screening uit de bus kwam als wel effectief, maar niet destructief), de pH van het ‘badje’ te variëren en het toepassen van elektrische spanning, lukte het de onderzoekers om de antlichamen diep in het binnenste te laten doordringen om ook daar aan de gewenste targets te binden. Met als resultaat een prachtig single-cell kijkje in het muizenbrein.
Dae Hee Yun, Young-Gyun Park, et al., Uniform volumetric single-cell processing for organ-scale molecular phenotyping, Nature Biotechnology (2025), doi:10.1038/s41587-024-02533-4



















Nog geen opmerkingen