Bacteriën compenseren voor het effect van de buitentemperatuur op hun celmembraan via een membraaneiwit waarvan de functie temperatuurafhankelijk is. In grote lijnen was dat al bekend maar een internationaal gezelschap onder leiding van UU-hoogleraar Antoinette Killian heeft het mechanisme nu op moleculaire schaal ontsluierd, zo valt te lezen in PNAS.
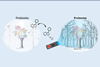
Dat mechanisme, voor het eerst ontdekt bij Bacillus subtilis, houdt de ‘vloeibaarheid’ van het celmembraan zo goed mogelijk constant. Bij lage temperatuur start het de aanmaak van een desaturase-enzym dat dubbele bindingen introduceert in de lipide-ketens van het membraan, zodat die minder stug worden. Genoemd membraaneiwit, genaamd DesK, is hiervan de trigger. Vermoed werd al dat het reageert op de dikte van het membraan, die bij temperatuurverlaging oploopt omdat de lipiden zich dan netter ordenen.
Samen met Argentijnse, Canadese en Nederlands/Duitse groepen hebben Killian en promovendus Joost Ballering nu metingen gedaan aan een sterk versimpeld DesK. Terwijl bij echt DesK vijf eiwitspiralen door het membraan steken, had ‘MS-DesK’ er nog maar één.
Een combinatie van experimenten en computermodellen maakte duidelijk wat er gebeurt. Vermoed werd al dat DesK aan dimeervorming doet. MS-DesK doet dat zeker: in een membraan zitten er altijd twee naast elkaar. Beide uiteinden drijven als het ware op de membraanoppervlakken; aan de binnenkant steekt een stukje uit en bij hoge temperatuur werken die twee eindgroepen samen als fosfatase-enzym.
Maar wanneer T daalt en het membraan dikker wordt, worden de spiralen opgerekt en verdraaien daarbij een beetje. Hierdoor komen drie van hun respectievelijke serinebouwstenen dicht genoeg bij elkaar om onderling waterstofbruggen te vormen. Die ‘serine-rits’ stabiliseert de nieuwe dimeerconfiguratie. De eveneens verdraaide eindgroepen werken dan ineens als kinase-enzym: in plaats dat ze een fosfaatgroep afsplitsen, plaatsen ze hem juist.
Lijdend voorwerp is in beide gevallen een enzym genaamd DesR, dat de desaturase-aanmaak regelt. Vandaar.
Zo’n serine-rits is vaker waargenomen bij membraaneiwitten. Dat hij op deze manier open en dicht kan gaan is nieuw, maar de onderzoekers vermoeden dat het niet uitzonderlijk is.
bron: UU, PNAS














Nog geen opmerkingen