Voor het eerst kunnen gistcellen dopamine maken uit glucose. Dat brengt efficiënte productie van opiaten in een fermentor angstig dichtbij, melden Berkeley-onderzoeker John Dueber en collega’s in Nature Chemical Biology.
Waarbij ze waarschuwen dat het dus hoog tijd is voor wetgeving die de verspreiding van dergelijke harddrugs poepende giststammen aan banden legt vóórdat ze straks op elke straathoek te koop zijn.
Hun eigen bijdrage aan dit doemscenario is een tyrosinehydroxylase-enzym dat het aminozuur L-tyrosine (dat door gistcellen via-via uit glucose wordt gemaakt) omzet in L-3,4-dihydroxyfenylalanine oftewel L-dopa. In de natuur bestaan verschillende van die enzymen en het was ook al gelukt om ze naar E.coli over te zetten, maar tot nu toe kon niemand er eentje vinden die het ook in gistcellen deed.
Dueber en collega’s hebben er nu eentje opgespoord met wat ze een ‘enzymgekoppelde biosensor’ noemen. In feite een tweede enzym dat het gevormde L-dopa direct omzet in intens gele bètaxanthine-pigmenten zodat je met het blote oog kunt zien of je pogingen succesvol zijn.
Eigenlijk dachten ze zo een hele bibliotheek van potentiële enzymen door te moeten akkeren, maar vóór het zover was liepen ze tegen iets aan dat veelbelovend genoeg was om verder mee te experimenteren. CYP76AD1 is recent ontdekt in suikerbieten; het zet dopa om in betanidine, dat chemisch verwant is aan betaxanthine maar de bieten violet kleurt in plaats van geel.
Het idee was om het dusdanig te veranderen dat het tyrosine in plaats van dopa kon gebruiken als substraat, maar tot verrassing van de onderzoekers bleek het van zichzelf al een redelijk goed tyrosinehydroxylase te zijn. Met wat gerichte mutatie-experimentjes werd het zelfs zó goed dat de gistcel gebrek aan tyrosine kreeg.
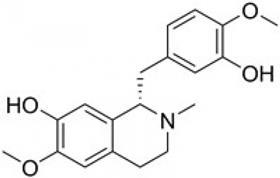
Door nog een paar eerder ontdekte enzymen in de gistcellen te monteren, is het gelukt om ze ook de verdere omzetting van L-dopa in achtereenvolgens dopamine, S-norcoclaurine en uiteindelijk S-reticuline te laten uitvoeren. Dat reticuline is de laatste gemeenschappelijke precursor in de natuurlijke syntheseroutes voor opiumderivaten en andere benzylisochinoline-alkaloïden.
En de rest van die syntheseroutes is jaren geleden al eens in gistcellen gemonteerd.
Voorlopig is de norcoclaurine- en reticulineproductie nog veel te inefficiënt om er iets mee te kunnen doen; er lijkt sprake van een hele reeks nevenreacties waar Dueber nog niet de vinger achter heeft. Maar het lijkt een kwestie van tijd voordat hij of iemand anders ook dat deel van het proces weet te optimaliseren. En dan is dus het hek van de dam: het is fijn dat medische opiumderivaten ongetwijfeld een stuk goedkoper worden, maar wat als de onderwereld massaal fermentoren aanschaft?
bron: Nature Chemical Biology, Berkeley















Nog geen opmerkingen