Colloïdale mengsels bestaande uit effectief twee componenten kunnen wel vijf fasen tegelijkertijd in evenwicht hebben, ontdekten Eindhovense onderzoekers.
Mengsels van colloïden en polymeren fascineren chemici al langer. Polymeren toevoegen aan een colloïdale dispersie heeft namelijk grote invloed op de interacties tussen colloïdale deeltjes. Wanneer je de vorm en relatieve grootte van colloïdale deeltjes aanpast, kun je zelfs een vijf-fasenevenwicht realiseren. Dat blijkt uit theoretisch onderzoek van Vincent Peters en Álvaro González García van de Technische Universiteit Eindhoven. ‘Kennis over fasengedrag van dit soort systemen geeft unieke nieuwe inzichten voor bijvoorbeeld levensmiddelen en verf’, zegt vakgroepleider en hoogleraar fysische chemie Remco Tuinier.
‘Kennis over fasengedrag geeft unieke nieuwe inzichten voor bijvoorbeeld levensmiddelen en verf’
Colloïdale deeltjes worden vaak beschreven als harde bollen. Meng je ze met niet-adsorberende polymeren, dan krijg je bijzondere interacties. ‘Polymeren kunnen niet te dicht bij de harde deeltjes komen zonder te vervormen’, vertelt Tuinier. ‘Op die manier ontstaan zogenaamde depletiezones rondom de colloïden. Die depletiezones bevatten minder polymeer dan de bulk, waardoor ze gaan overlappen. Op dat moment kan een polymeer niet meer tussen de colloïde deeltjes komen. De osmotische druk uitgevoerd door de polymeren op de bollen is dan niet meer in balans. Het gevolg is dat je fasenscheiding krijgt.’

Het leuke is volgens Tuinier dat je dit proces op allerlei manieren kunt beïnvloeden. ‘De dracht van de interactie kun je veranderen door de polymeergrootte aan te passen. En de polymeerconcentratie bepaalt de sterkte van het depletie-effect. Hoe geconcentreerder, hoe eerder de boel ontmengt.’
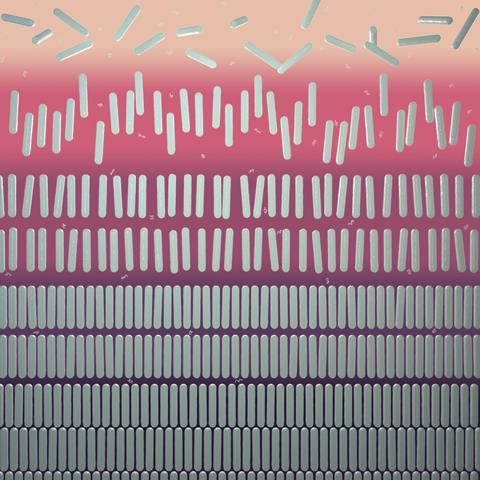
Maar recent is dus ontdekt dat het pas écht interessant wordt wanneer je gaat sleutelen aan de colloïden zelf. Neem je plaatjes of staafjes, dan krijg je ontmenging in respectievelijk vier en vijf fasen. Dat gaat volgens Tuinier als volgt: ‘Als de staafjes een iets hogere dichtheid hebben dan de polymeren, dan zakt die fase naar de bodem. Daar nemen ze geordende posities in.’
Transities voorspellen
Uiteindelijk krijg je volgens Tuinier onder specifieke omstandigheden dan de volgende vijf fasen: een colloïdale gasfase met niet-gerangschikte staafjes bovenaan (isotrope fase), een vloeibare fase met staafjes die dezelfde kant op wijzen (nematisch vloeibaar kristal), een vloeibare fase met staafjes die in verschillende lagen liggen (smectisch vloeibaar kristal), en twee vaste, maar verschillend geordende kristalfasen onderaan. Met deze vijf fasen lijkt het systeem zelfs de klassieke fasenregel van Gibbs (zie kader) te tarten.
Het onderzoek van Tuinier en collega’s over faseovergangen van colloïdale mengsels helpt om beter te voorspellen onder welke condities dit soort transities plaatsvinden. En dat kan weer van pas komen in bijvoorbeeld de levensmiddelen- en verfindustrie. ‘Aan sladressing worden polysachariden toegevoegd om de juiste viscositeit in te stellen’, zegt Tuinier. ‘Maar dat kan tegelijkertijd leiden tot instabiliteit van de emulsie. Datzelfde geldt voor verf, waarbij diverse colloïdale deeltjes (binders en pigmenten, red.) worden gemengd met elkaar en met polymeren.’
Natuurlijk blijft het fundamentele aspect nog altijd mateloos fascinerend, geeft Tuinier aan. ‘Wat is bijvoorbeeld de rol van ladingen van de componenten op het fasengedrag? Dat is een van de volgende vragen waar we ons op willen storten.’ Genoeg ‘magie’ van colloïdale mengsels om nog te ontdekken dus.
De fasenregel van Gibbs uitgebreid
De Amerikaanse fysisch-chemicus Josiah Willard Gibbs stelde zo’n honderdvijftig jaar geleden de klassieke fasenregel op voor een chemisch systeem. Toegepast op een colloïd-polymeer mengsel (waarbij temperatuur geen rol speelt) geldt deze formule:
V = C - F + 1
Daarbij is V het aantal vrijheidsgraden, C het aantal componenten en F het aantal fasen. Het oplosmiddel geldt als achtergrond. En dus heeft C de waarde van 2 voor een colloïd-polymeer-mengsel. Het aantal fasen (F) dat in evenwicht is dan drie. Uit Remco Tuiniers onderzoek blijkt echter dat dit niet volstaat wanneer er in plaats van bollen sprake is van bijvoorbeeld staafjes als colloïden. Rekening houdend met de vorm én grootte van deeltjes wordt de fasenregel in dit soort systemen anders:
V = C - F + S + 1
Daar is S het aantal onafhankelijke relatieve lengteschalen die de toestand van het systeem kan beïnvloeden. En zo klopt – met een kleine uitbreiding – de fasenregel van Gibbs alsnog.
















Nog geen opmerkingen