Met NADPH-dehydrogenase kun je niet alleen reduceren, maar ook oxideren als je simpelweg de pH verhoogt, laten Delftse onderzoekers zien in ChemCatChem.
Enzymen zijn de organisch chemici van de biologie. Geen wonder dat sommige chemici deze reactiemachines willen inzetten om chemische reacties uit te voeren. Een zo’n enzymfamilie die zich al richting de industriële toepassingen beweegt is NADPH-dehydrogenase, ook wel Old Yellow Enzyme (OYE) genoemd.
Traditioneel worden OYE’s ingezet voor reducties van geconjugeerde C=C-bindingen. Nu waren er al aanwijzingen dat het omgekeerde ook mogelijk moet zijn, dus besloten de groepen van Frank Hollmann en Caroline Paul om uit te zoeken in hoeverre je ook kunt oxideren met OYE’s.
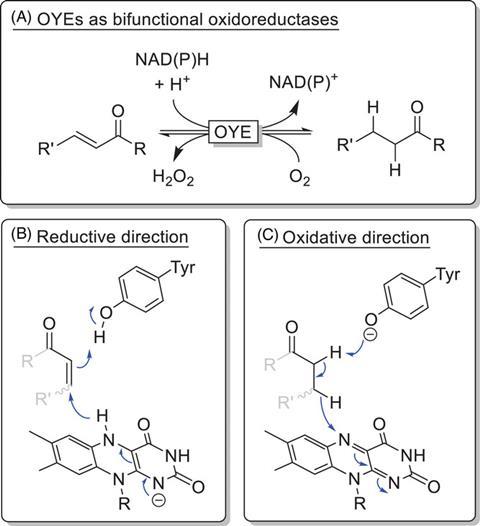
Aan OYE is flavine-mononucleotide (FMN) gebonden. Deze structuur kan de reductiestap in gang zetten door zijn hydride te gebruiken in een soort Michael-additie. OYE maakt de reactie netjes af door het ontstane enolaat te protoneren via een tyrosine in het enzym.
Die tyrosine bleek een sleutelrol te spelen. OYE’s worden meestal gebruikt bij een pH tussen de 6 en de 8, waar tyrosine geprotoneerd blijft. Maar bij een hogere pH (hier 8,5) verliest het zijn proton, waardoor het als base kan fungeren en de oxidatieve reactie van OYE kan inzetten, waarbij FMN het hydride weer opvangt.
De onderzoekers pasten deze reactie toe op verschillende substraten en zagen – zoals verwacht – dat dezelfde substraten die normaal reductie ondergaan nu ook geoxideerd werden. Er is vast nog veel meer mogelijk, maar ze beperkten zich tot een paar standaardvoorbeelden om het principe te laten zien. Het mooie van deze reactie is daarnaast ook dat je het niet echt hoeft te verwarmen: bij 30 °C werkt het al prima.
Als laatste wilden ze weten of andere OYE’s dan de door hen onderzochte OYE uit de bacterie Thermus scotoductus óók oxideren bij een simpele pH-verhoging. Daarbij sprong er een aantal OYE’s in het oog dat een flinke activiteit liet zien en dus verder kan worden onderzocht. Het biedt in ieder geval een nieuwe oxidatietool voor biokatalyse met OYE’s.
Van Hengst, J.M.A. et al. (2024) ChemCatChem e202401447, DOI: 10.1002/cctc.202401447




















Nog geen opmerkingen