Een samenwerking tussen onderzoekers uit Eindhoven, Essen en New York zet in op een ‘moleculaire lijm’ als behandeling van diabetes type 2. De lijm richt zich voornamelijk op het ChREBPα eiwit dat betrokken is bij de verwerking van glucose en het activeren van de insulineproductie.
In 2020 publiceerde de groep van Luc Brunsveld van de TU Eindhoven een onderzoek naar de interactie van kleine moleculen op eiwitten buiten de cel. De groep van Donald Scott, van de Icahn School of Medicine at Mount Sinai (New York) wilde deze kennis gaan toepassen op diabetes type 2 en namen daarom contact op met Eindhoven. Emira Visser, destijds promovendus in bij Brunsveld,: ‘Dit is een van mijn favoriete projecten waar ik aan heb gewerkt.’
Overproductie
Het 14-3-3 eiwit, waar de onderzoeksgroep van Brunsveld al langere tijd onderzoek naar doet, gaat in de bètacellen een interactie aan met het ChREBPα eiwit in het cytosol. ChREBPα speelt een rol in het verwerken van glucose in het lichaam. Zodra er glucose flux is, splitsen de twee eiwitten en zorgt ChREBPα voor het activeren van het ChREBPβ transcript in de celkern, wat leidt tot proliferatie van de bètacellen . Als er langere tijd veel glucose aanwezig is in het bloed wordt een heftige positieve feedbackreactie aangewakkerd. Dit zorgt ervoor dat ChREBPβ aan zijn eigen activatie site bindt waardoor er een overvloed aan ChREBPβ wordt aangemaakt. Dit leidt uiteindelijk tot glucolipotoxicity en het afsterven van de bètacellen. Centrale vraag in dit onderzoek was hoe deze overproductie kan worden voorkomen.
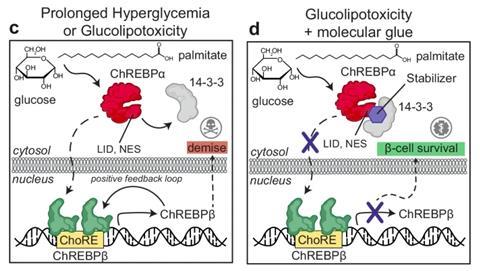
De binding tussen ChREBPα en het 14-3-3 eiwit is belangrijk om die overproductie van ChREBPβ tegen te gaan. ‘De binding tussen deze eiwitten is een normaal biologisch fenomeen en wij maken daar gebruik van. Daarmee is het dus geen compleet nieuw proces dat je opwekt’, zegt Visser. Zolang de twee eiwitten aan elkaar zijn gebonden, remt dit de productie van ChREBPβ in de celkern. Visser: ‘Door het vastlijmen van eiwitten, ben je in staat om de functie van één van die eiwitten te remmen’. Door van dit principe gebruik te maken, hebben de onderzoekers een lijm ontworpen die beide eiwitten aan elkaar vastplakt en zo de werking van ChREBPα remt.
Magisch fluor
‘Het is belangrijk om de moleculaire lijm af te stemmen op de specifieke binding tussen ChREBPα en 14-3-3 omdat deze laatste nog veel meer bindingen aangaat in de cel’, zegt promovendus Marloes Pennings, die in de Brunsveld-groep hieraan werkt. De natuurlijke stabilisator AMP is gebruikt als richtlijn voor de moleculaire lijm. De lijm heeft een vergelijkbare werking, maar verschilt qua vorm en opbouw flink van de AMP. ‘Om te zorgen dat de de lijm daadwerkelijk effectief is, moet die de cel binnen kunnen komen. Maar de lijm bevat een sterk negatief geladen fosfonaatgroep en we dachten dat dit voor problemen ging zorgen, omdat de celmembraan ook negatief geladen is. Maar verbazingwekkend genoeg werkte het juist wel’, vertelt Visser.
De oplossing kwam vanuit de groep van Markus Kaiser in Essen. Zij waren verantwoordelijk voor het synthetisch-organische werk binnen de samenwerking en kwamen met het plan om fluorgroepen in te brengen. ‘Dat werkte als magie’, zegt Visser. Ook bij verbindingen die aanvankelijk niet effectief bleken. De lijm nestelt zich in de pocket die ontstaat als de twee eiwitten met elkaar binden. Visser: ‘Deze binding is essentieel, zonder de binding kan de lijm niks beginnen.’De lijm die door de Brunsveld groep is ontworpen heeft dus een specifieke toepassing op deze ene eiwit-eiwit interactie. Wel staat er nu een bepaalde basis kennis over de moleculaire lijm waarop ze verder kunnen varieren en bouwen ook bij andere ziekten toe te passen.
Momenteel lopen bij Mount Sinai in New York de eerste in vivo experimenten met de moleculaire lijm. In een muismodel wordt gekeken of de glucosespiegels daadwerkelijk veranderen en wat de klaring van het molecuul in het lichaam is.
Liora Katz, Emira Visser, Kathrin Plitzko, Marloes Pennings, et al., Molecular glues of the regulatory ChREBP/14-3-3 complex protect beta cells from glucolipotoxicity, Nature Communications (2025), doi:10.1038/s41467-025-57241-7



















Nog geen opmerkingen