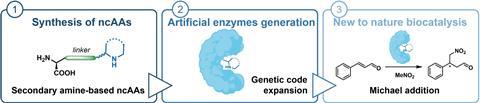
Het lukte Amsterdamse wetenschappers om aminozuren met een secundair amine in te bouwen in een eiwit om het zo een enzymatische functie te geven, staat in ChemCatChem.
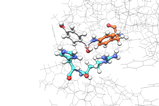
Voor het maken van moleculen bestaan vele technieken, maar een relatief schone variant is het gebruik van enzymen als katalysator voor bepaalde reacties. Beperk je je echter tot natuurlijke enzymen, dan zijn je reactiemogelijkheden beperkt. Daarom maken wetenschappers al jaren varianten of eigen versies van enzymen of eiwitten, soms met niet-natuurlijke aminozuren (ncAA’s). Alejandro Gran-Scheuch, Elisa Bonandi en Ivana Drienovská van de Vrije Universiteit Amsterdam, combineerden de populairste organokatalytische functies met een niet-enzymatisch eiwit en creëerden zo voor het eerst artificiële enzymen met secundaire amines.
‘Dat ze erin geslaagd zijn die niet-canonieke aminozuren met secundaire aminozuren in te bouwen, dat vind ik heel bijzonder’, vertelt Gerard Roelfes, hoogleraar biomoleculaire chemie & katalyse aan de Rijksuniversiteit Groningen. ‘Die secundaire amines gebruik je in heel veel organokatalytische reacties; het mooie van dit artikel is dat ze laten zien dat je dat soort reacties nu dus met een gemodificeerd eiwit kunt katalyseren.’
In de paper lichten de onderzoekers ook de elegante synthese van zes ncAA’s uit. Het is een redelijk simpel protocol met goede opbrengsten en de laatste paar stappen gaan voor alle zes ongeveer hetzelfde, met respectievelijk een basische en een Pd-gekatalyseerde hydrolyse. Maar hoe krijg je enzymen zo ver dat ze die ncAA’s incorporeren en daarmee kunnen werken?
Lees verder onder de afbeelding
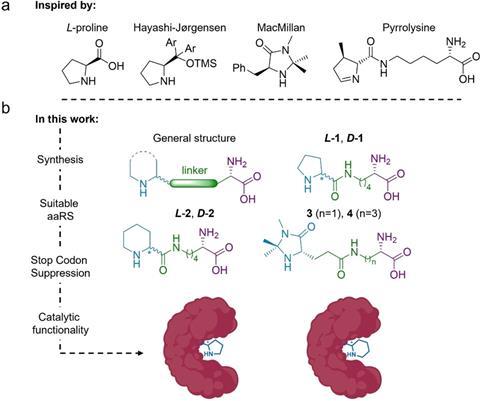
Drienovská is gepromoveerd in de groep van Roelfes en heeft daar al eerder met dit eiwit (lactococcal multidrug resistance regulator, LmrR) gewerkt, vertelt hij. ‘De methode om ncAA’s in te bouwen in eiwitten bestaat ook al zo’n twintig jaar, maar die is nu zo ver ontwikkeld dat het ook voor chemici vrij makkelijk te gebruiken is.’ Om zo’n ncAA in te bouwen gebruik je de techniek stop-codon suppression. Roelfes: ‘Dat werkt simpel gezegd als volgt: in het genetische materiaal van de bacterie waarin je de eiwitten wilt maken herprogrammeer je een van de drie stopcodons, zodat het ribosoom het leest als signaal om een ncAA in te bouwen in plaats van de translatie te beëindigen. Je gebruikt hiervoor een orthogonaal translatiesysteem dat bestaat uit een tRNA uit een heel ander organisme en een enzym dat het tRNA laadt met het gewenste ncAA, zodat het daarna door het ribosoom geaccepteerd wordt.’
Op deze manier maakten de onderzoekers vier verschillende eiwitten; twee van de ncAA’s kregen ze niet geïncorporeerd. De eiwitten hebben zo een enzymatische functie gekregen. Om te laten zien dat het werkt, deed het Amsterdamse team een reactie tussen nitromethaan en cinnamaldehyde met en zonder de enzymen als katalysator. Hoewel het maar bij twee varianten tot een redelijke opbrengst kwam (31 en 15%), staat vast dat het werkt. ‘Dit is echt proof-of-principle-werk’, vertelt Roelfes. ‘Deze gevonden basisactiviteit kun je nu gaan verbeteren met directed evolution. Dat hebben ze hier nog niet gedaan, maar daarmee kun je die activiteit nog behoorlijk opschroeven.’ De bal ligt dus op de stip, het veld hoeft alleen nog het doelpunt te maken.
Gran-Scheuch, A. et al. (2023) ChemCatChem, DOI: 10.1002/cctc.202301004
















Nog geen opmerkingen