Een team uit Groningen en Barcelona heeft opgehelderd wat er gebeurt als je een designer enzym met onnatuurlijke aminozuren door een gestuurde-evolutiecampagne laat gaan, zoals te lezen in ACS Catalysis. ‘Dit hadden we helemaal niet voorzien.’
Enzymen zijn fantastische katalysatoren, maar ze zijn meestal ook hyperspecifiek, wat wil zeggen dat ze één chemische reactie extreem goed kunnen uitvoeren. Dit speelt ook een rol bij het ontwerpen van nieuwe enzymen. ‘Een andere beperking is dat je maar een beperkt aantal reacties kunt doen met natuurlijke enzymen’, zegt Reuben Leveson-Gower, universitair docent aan de TU Delft. ‘In het lab van Gerard Roelfes - waar ik mijn PhD heb gedaan - hebben ze een interessante strategie opgezet om de reacties uit te breiden.’ De groep van Roelfes gebruikt namelijk onnatuurlijke aminozuren in hun enzymontwerpen. ‘Codeer je die in enzymen, dan krijg je nieuwe chemische functies.’
Tijdens zijn PhD gebruikte Leveson-Gower para-aminofenylalanine (pAF) om organokatalysatoren na te bootsen. ‘Organokatalyse is heel nuttig voor chemische syntheses en was natuurlijk goed voor de Nobelprijs in 2021. Dit type chemie zou echt sterk en efficiënt kunnen zijn als je het in een enzym zou doen, en dat is precies wat ons is gelukt.’
Promiscuïteit

De voorgangers van Leveson-Gower, Ivana Drienovská en Clemens Mayer, ontwikkelden aanvankelijk het kunstmatige enzym met pAF en Mayer leidde een campagne van gestuurde evolutie om de zijketens van de active site te optimaliseren. Toen hij het project aan het begin van zijn promotie overnam, richtte Leveson-Gower zich echter op de promiscuïteit van het kunstmatige enzym, dat wil zeggen het vermogen om twee zeer verschillende reacties te katalyseren. ‘De resultaten waren nog niet perfect, dus deed ik mijn eigen gestuurde-evolutiecampagne’, legt hij uit. ‘Maar toen we dat deden, zagen we dat dit proces ervoor zorgde dat het enzym zich specialiseerde en zijn veelzijdigheid juist verloor, net als wat er gebeurt in natuurlijke enzymen. Daarom wilden we uitzoeken wat dit veroorzaakte en de resultaten daarvan hebben we in dit artikel gepubliceerd.’
Samen met collega’s uit Barcelona combineerde de Roelfes-groep mutagenese, computationele chemie en structurele biologie om het onderliggende mechanisme te ontdekken. ‘Het was een behoorlijk grote teamprestatie met samenwerking tussen disciplines, en het was erg leuk om samen te werken met mensen met verschillende achtergronden.’
Totaal verschillend
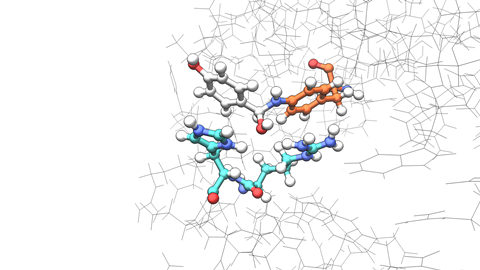
Het team had twee belangrijke en onverwachte bevindingen. ‘Sommige mutaties zorgden ervoor dat het eiwit zelf op een onverwachte manier van vorm veranderde, iets wat we helemaal niet hadden verwacht’, zegt Leveson-Gower. ‘We verwachtten dat mutaties rond de active site de polariteit of iets dergelijks zouden veranderen. Maar ze veranderden hoe het eiwitdimeer bij elkaar kwam. De active site ligt tussen de twee subeenheden in en de mutaties herschikten de quaternaire eiwitstructuur, wat een heel ander effect gaf.’
Een andere opmerkelijke observatie was dat de mutaties die het team introduceerde een sterk zogenoemd epistatisch effect hadden. ‘De individuele mutaties lieten maar weinig verbeteringen zien in ons enzym, maar het combineren van meerdere mutaties leidde tot een veel groter effect’, legt Leveson-Gower uit. ‘We denken dat de mutaties een nieuw en verbeterd patroon van waterstofbruggen creëerden dat de actieve plaats stabiliseerde. Wanneer we één waterstofbrugdonor verwijderden en een nieuwe toevoegden, konden we het reactiepad in een nieuwe richting sturen.’
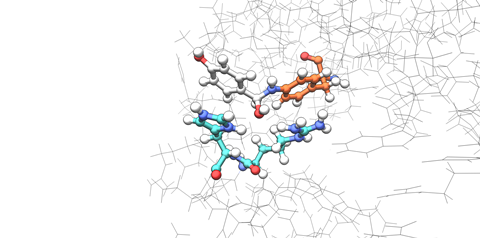
Volgens de universitair docent laat dit ook zien dat slechts een klein aantal mutaties radicale veranderingen kan veroorzaken in de functie van een ontworpen onnatuurlijk enzym. ‘We zien dat de onnatuurlijke componenten die we gebruiken nauw kunnen samenwerken met de natuurlijke aminozuren waaruit het omringende eiwit is opgebouwd. We hoopten dat dit waar zou zijn, maar nu hebben we óok echt bewijs om aan te tonen dat het daadwerkelijk gebeurt.’
Muur
Het project verliep echter niet altijd van een leien dakje. ‘Ik moest tijdens dit project helemaal vanaf nul leren hoe ik een computationeel chemicus moest zijn’, herinnert Leveson-Gower zich met een glimlach. ‘Ik deed het grootste deel van de berekeningen en leerde de meeste technieken tijdens een stage in Barcelona.’ Er was veel troubleshooting, ‘mijn hoofd tegen de muur slaan’, maar over het algemeen was het erg nuttig. ‘Het was een mooie gelegenheid om te leren en ook heel waardevol om onderzoek te doen in een ander land; dat geeft een ander perspectief.’
Wat is de conclusie van dit werk? Leveson-Gower: ‘Wat we hier hebben gekarakteriseerd is een manier waarop onnatuurlijke aminozuren kunnen samenwerken met natuurlijke aminozuren om de efficiëntie van katalytische reacties te verhogen. Het kan dienen als een motief voor anderen om te volgen.’ Om het beste uit gestuurde evolutie te halen, moet je het opvolgen met een mechanistische studie om te zien wat er precies is gebeurd. ‘Zo gaan we steeds meer in de richting van rationele benaderingen voor het verbeteren van onnatuurlijke enzymen.’
Leveson-Gower, R.B. et al. (2025) ACS Catal. 15(3), DOI: 10.1021/acscatal.4c06409


















Nog geen opmerkingen