Sluit het enzym FDH op in een metal-organic framework (MOF) met magnetiet en het is stabiel genoeg om na CO2-reductie te worden gerecycled, laten Argentijnse onderzoekers zien in Chemistry – A European Journal.
Waar de mens heel veel moeite steekt in omzetten van het inerte CO2 in iets nuttigs, heeft de natuur daar interessante nanomachines voor in de vorm van enzymen. Het enzym formiaatdehydrogenase (FDH) zet normaal methanoaat (formiaat) om in CO2, maar onder bepaalde condities gebeurt het andersom.
Dat gegeven wilden Matías Aguirre, Cristina Ramírez en Yesica Di Iorio van de Universidad Nacional de Mar del Plata uitbuiten. Zoiets was al eens geprobeerd, door bijvoorbeeld het vrije enzym te gebruiken of het ergens op vast te zetten, maar de resultaten waren nog niet naar behoren, dus gooiden zij het over een andere boeg: ze sloten het op in een metal-organic framework.
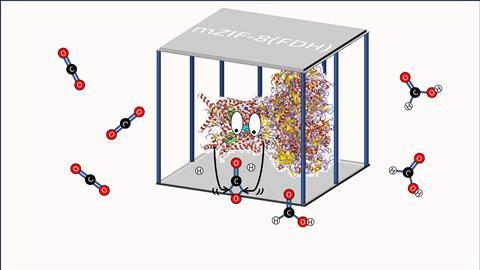
Het betreffende MOF is ZIF-8 dat bestaat uit zink(II)-ionen en 2-methylimidazol-moleculen dat je in water kunt synthetiseren bij kamertemperatuur. Dat is best handig als je enzymen – die zich van nature in een waterig milieu begeven – in een MOF zou willen opsluiten. Wat ze ook toevoegden was magnetiet (Fe3O4). Tijdens het syntheseproces gaan kleine stukjes magnetiet aan het MOF zitten, waardoor je het MOF met een magneet kunt aantrekken.
Als laatste was de biokatalysator NADH nog nodig. De reactie van CO2-omzetting is in werkelijkheid namelijk een evenwicht, waarbij de reactie richting CO2 de voorkeur heeft. Met NADH kun je dat evenwicht de andere kant opsturen.
Vervolgens vergeleken de onderzoekers de CO2-omzetting van het vrije FDH met de opgesloten variant [mZIF-8(FDH)], waarbij NaHCO3 (‘opgelost CO2’) als CO2-bron goldt. Daaruit bleek dat het gekooide mZIF-8(FDH) 3,4 keer meer CO2 omzet dan het vrije FDH (1015 vs. 300 µmol per liter per uur per milligram).
Door de magnetietdecoratie kun je het geheel ook nog eens recyclen na de reactie. Na drie reactierondes was er slechts 5% activiteit verloren en na vijf rondes was er nog 86% activiteit over. Al met al geeft de studie een efficiënt en enzym-vriendelijk raamwerk dat je wellicht ook voor andere enzymen kunt inzetten, aldus de auteurs.
Aguirre, M.E. et al. (2023) Chem. Eur. J. e202301113, DOI: 10.1002/chem.202301113




















Nog geen opmerkingen