In een artikel uit 2023 in JACS werd voorgesteld om de definitie van waterstofbruggen uit te breiden met hydriden. Een team uit Amsterdam pleit nu in hetzelfde tijdschrift ervoor om de definitie van waterstofbruggen juist te houden zoals ze is.
De International Union of Pure and Applied Chemistry (IUPAC) regelt de naamgeving en definities van chemische termen. Het is ontzettend belangrijk dat deze definities duidelijk zijn; een verkeerde definitie kan leiden tot verkeerde theorie en uiteindelijk verkeerde toepassingen.
Neem de waterstofbrug (H-brug). IUPAC definieert het als ‘een aantrekkende interactie tussen een waterstofatoom van een molecuul of een molecuulfragment Y-H, waarbij Y elektronegatiever is dan H, en een atoom of groep atomen (Z), waarbij er bewijs is van bindingvorming (d.w.z. een Y-H···Z waterstofbrugcomplex)’. Dit bindingsmotief is zeer goed gedefinieerd en begrepen: het bindingsmechanisme is een HOMO-LUMO interactie tussen het vrije elektronenpaar van Z en de σ*-acceptororbitaal van Y-H. Dit mechanisme vormt de basis van veel theoretische en praktische kennis.
Zorgwekkend voorstel
In een artikel dat in 2023 in JACS werd gepubliceerd, suggereerde een team van Tsjechische onderzoekers onder leiding van Svatopluk Civiš en Pavel Hobza echter dat de IUPAC-definitie niet compleet was. ‘We vonden het nogal zorgwekkend’, zeggen postdoc Lucas de Azevedo Santos en professor Célia Fonseca Guerra van de TheoCheM-groep aan de VU Amsterdam. ‘Hun voorstel suggereerde dat wat we wisten over waterstofbruggen niet klopte. Het zou de theorie en het concept achter waterstofbruggen compleet veranderen.’
In hun paper voegden Civiš, Hobza en collega’s slechts twee woorden toe aan de IUPAC-definitie [nadruk toegevoegd, red.]: ‘De waterstofbrug is een aantrekkende interactie tussen een waterstofatoom van een molecuul of een molecuulfragment X-H waarbij X meer of minder elektronegatief is dan H en een atoom of een groep atomen in hetzelfde of een ander molecuul waarbij er bewijs is van bindingsvorming. Een typische waterstofbrug kan worden weergegeven als X-H···Y-Z, waarbij de drie stippen de binding aangeven.’
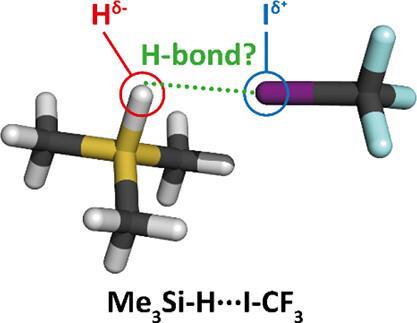
‘In wezen zeggen ze dat een negatief geladen waterstofatoom kan fungeren als waterstofbrugdonor’, legt Fonseca Guerra uit. ‘Ze suggereren dat hydridische waterstofatomen in X-Hδ- lading kunnen accepteren van een vrij elektronenpaar op Z. Maar dan heb je het over het doneren van elektronen aan een al negatief geladen waterstofatoom met een zeer hoge energie σ* LUMO, en wat wij weten over waterstofbruggen zegt dat dat niet gunstig is.’
Gezond debat
Samen met VU-collega’s Pascal Vermeeren en Matthias Bickelhaupt besloten ze op te schrijven wat een H-brug volgens hen wel en niet is, en dat in hetzelfde tijdschrift te publiceren. ‘Op deze manier bereiken we hetzelfde publiek, zodat ze beide kanten van het argument kunnen zien’, voegt De Azevedo Santos toe. ‘Het zorgt voor een gezonder debat.’
Het Amsterdamse team kwam met een aantal eenvoudige argumenten, ondersteund door computationele chemie. ‘Eerst namen we ammoniak, omdat van ammoniak bekend is dat het kan fungeren als waterstofbrugacceptor’, vervolgt de postdoc. ‘Vervolgens modelleerden we een verzameling monomeren met negatief geladen waterstofatomen – de hydriden – en een verzameling monomeren met positief geladen waterstofatomen – de protonen. De hydriden vormen geen waterstofbruggen met ammoniak, terwijl de protonische waterstoffen dat wel doen, in overeenstemming met de traditionele IUPAC-definitie.’
Over de aard van bindingen
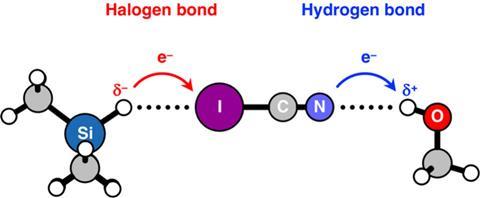
Als protonen H-bruggen vormen, wat voor bindingen vormen hydriden dan? Dit was de volgende vraag die het team wilde beantwoorden. Fonseca Guerra: ‘We kozen I-C≡N bewust als ons tweede systeem, omdat het waterstofbruggen kan vormen aan de N-kant en halogeenbindingen aan de I-kant.’ Als bron van H-atomen gebruikten ze MemY-H-moleculen, waarbij Y dan C, Si, Ge, N, P, As, O, S of Se kan zijn. Afhankelijk van welk atoom je kiest is Y elektronegatiever of elektropositiever dan het H-atoom.
‘Allereerst bevestigden we op deze manier dat hydriden alleen aan de jodiumkant binden. Vervolgens keken we naar de ladingsdonatie van het vrije elektronpaar op het I-atoom aan de σ* LUMO van de hydriden en ontdekten dat deze erg zwak is’, zegt de Azevedo Santos. ‘Het punt is dat hydriden bindingsacceptoren zijn, geen donoren – ze geven lading af aan een ander monomeer. De binding tussen een hydride en het jodiumatoom in ICN zou je classificeren als een halogeenverbinding. Als je alle verschillende atomen in Y in MemY-H doorloopt die aanleiding geven tot hydriden, is het hydride altijd een bindingsacceptor, geen bindingsdonor.’ Fonseca Guerra voegt toe: ‘Inderdaad, en we zien dat de hydriden altijd halogeenbindingen vormen met jodium in I-CN, en lading afstaan aan de σ*I-CN, terwijl protonisch waterstof altijd bindt aan stikstof in NC-I en lading accepteert van het vrije elektronpaar op stikstof.’ Conclusie: het is niet nodig om de IUPAC-definitie te veranderen.
Het roodverschuivingsargument
‘De focus van het betoog van Civiš en Hobza was gebaseerd op spectroscopische criteria, de zogenaamde roodverschuiving’, vervolgt De Azevedo Santos. ‘Wanneer een waterstofbrug wordt gevormd, kun je de verlenging van de Y-H-binding waarnemen in de vorm van een roodverschuiving in het IR-spectrum. Iets soortgelijks zie je ook gebeuren in een hydridecomplex. Maar die waarneming ondersteunt niet de conclusie dat die laatste ook een waterstofbrug is.’
Wat is dan de reden voor de roodverschuiving? ‘Bij waterstofbruggen is het bekend dat de Y-H-binding uitrekt wanneer deze elektronen accepteert in zijn antibindende σ*Y-H-orbitaal’, legt De Azevedo Santos uit. ‘Wat we in de hydridesituatie hebben laten zien is dat het uitrekken van de Y-H-binding komt doordat diens bindende σY-H-orbitaal elektronendichtheid verliest. Dat betekent dus dat er twee verschillende redenen zijn voor het langer worden van de Y-H-binding.’
Juist of onjuist?
In hun JACS-paper schrijft het Amsterdamse team: ‘We falsifiëren de conclusie dat interacties waarbij protonische en hydridische waterstoffen betrokken zijn allebei waterstofbruggen zijn; dat zijn ze niet.’
Voor Fonseca Guerra gaat het er niet zozeer om te wijzen op het ongelijk van Civiš en Hobza. ‘Ik wilde dat het constructiever zou zijn: hoe kunnen we onze argumenten opbouwen om onze lezers te overtuigen, zodat ze zelf kunnen beslissen welk idee goed of fout is? Het is niet wij tegen andere onderzoekers, maar de lezer meenemen door het manuscript zodat ze kunnen zien hoe onze argumenten zijn opgebouwd.’
‘Wetenschappelijk debat is soms gevoelig en provocerend’, zegt De Azevedo Santos. ‘Maar het is een interessante ervaring, het zet je aan het denken en je gaat terug naar de fundamentele basis om te begrijpen hoe dingen nu écht werken.’ Hij hoopt dat dit debat toegankelijk zal zijn voor het grote publiek. ‘Deze basis is belangrijk om te begrijpen. Het laat zien dat we allemaal voorzichtig moeten zijn met het trekken van conclusies uit waarnemingen. Soms is er meer aan de hand dan je op het eerste gezicht zou denken.’



















Nog geen opmerkingen