Een paradigma in de organische chemie dat al sinds 1931 in gebruik is, blijkt niet te kloppen, vonden Amsterdamse wetenschappers. Niet koolstof s–p hybridisatie, maar sterische repulsie zorgt voor het variëren van bijvoorbeeld C–H-bindingslengten. ‘Deze ontdekking is al zo’n twintig jaar in de maak.’
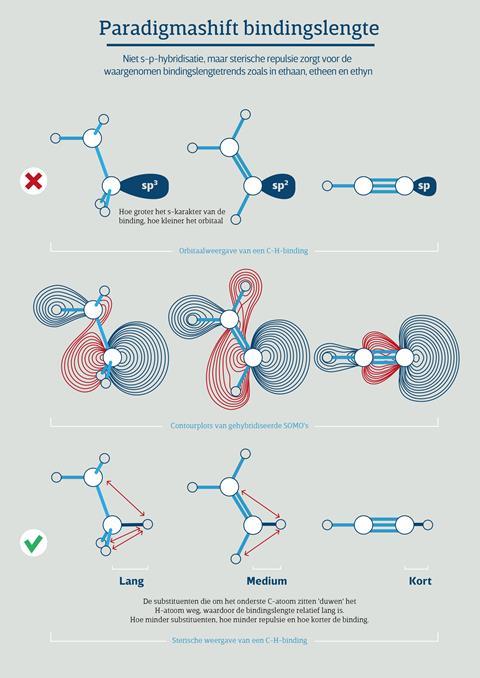
Het behoort eigenlijk tot de standaardregels in (fysisch-) organische chemie-leerboeken: de bindingslengte tussen twee atomen wordt korter als je het s-karakter van één van de twee atomen vergroot. Dus in de hybridisatietrend sp3-sp2-sp verkleint de afstand tussen atomen, zoals de C–H-binding in ethaan, etheen en ethyn. ‘Voor onze ontdekking is eigenlijk nooit met kwantitatieve kwantumchemische methodes uitgezocht of dat echt zo werkt’, vertelt Matthias Bickelhaupt, hoogleraar theoretische chemie aan de Vrije Universiteit Amsterdam. ‘Ja, de hybridisatie-regel lijkt plausibel en je kunt ook dikwijls overeenkomstige correlaties observeren. Maar of s–p hybridisatie de reden is voor bindingslengtetrends, is nooit kwantummechanisch bewezen.’
Toch bestond er al eerder een vermoeden bij Bickelhaupt door onderzoek van zo’n twintig jaar geleden. ‘Destijds onderzochten we waarom de stikstof–fluorbinding in het molecuul N2F+ de kortste binding ooit gemeten is’, vervolgt hij. ‘Vergeleken met NF4+ was de N–F-binding in N2F+ korter en we dachten eerst dat het door hybridisatie kwam. Maar na meer onderzoek bleek dat dus niet zo te zijn.’
‘Regels hebben hun nut, maar als wetenschapper wil je gewoon weten hoe het écht zit’
Hoewel de hybridisatietrend wel aanwezig was, bleek deze niet verantwoordelijk voor de korte binding. Bickelhaupt: ‘Waar we toen achter kwamen was dat de N-F-binding van NF4+ veel meer sterische repulsie ondervond door het grotere aantal substituenten dan in N2F+.’ In de conclusie wierp hij met zijn medeonderzoekers daarom de vraag op of dit sterische effect ook in de veel vaker voorkomende C–H- en C–C-bindingen te zien zou zijn.
Helaas kwam er van alles tussendoor, maar een paar jaar geleden pakte een team bestaande uit Bickelhaupt, Pascal Vermeeren, Willem-Jan van Zeist, Trevor Hamlin en Célia Fonseca Guerra het onderwerp opnieuw op. En jawel, hetzelfde sterische effect is ook in die alomtegenwoordige bindingen te zien. Het leverde een coverpositie op in Chemistry – A European Journal (zie ook de illustratie).
Kwalitatief en kwantitatief
De onderzoekers gebruikten een kwantitatieve moleculaire orbitaal-theorie (MO) in combinatie met een energiedecompositie-analyse. Daarmee vorm je een model dat zowel de mechanismen en causale verbanden blootlegt als de daarmee verbonden effecten kwantificeert. ‘Daarmee kunnen we dus kwalitatief én kwantitatief vaststellen hoe belangrijk bepaalde effecten zijn.’
Hoe zit het dan precies met die sterische repulsie? De C–H-bindingsoverlapping bereikt inderdaad haar optimum bij kortere afstand als je van sp3 naar sp gaat. Interessant genoeg ligt dat optimum echter bij zeer korte afstanden, ruwweg bij zo’n 0,7 Å en dus ver beneden de C–H-evenwichtsafstanden van 1,07 tot 1,10 Å. Rond die uiteindelijke bindingslengte domineert een totaal ander mechanisme, namelijk de sterische afstoting (Pauli-repulsie) tussen de substituenten (H-, CH3-, H2C= of HC≡) rond het koolstofatoom van de betreffende C–H-binding. ‘Deze sterische afstoting is een manifestatie van de zogenoemde Pauli-repulsie tussen elektronen van gelijke spin’, legt Bickelhaupt uit, ‘en deze neemt uiteraard af als je van 4, naar 3 naar 2 substituenten gaat rond de koolstofatomen in respectievelijk ethaan, etheen en ethyn.’
‘Een hoop zaken los je door blindelings uitproberen gewoon nooit op’
De belangrijkste implicatie van deze ontdekking vindt Bickelhaupt het vervangen van de oeroude empirische regels. ‘Die regels hebben hun nut, begrijp me niet verkeerd, maar als wetenschapper wil je gewoon weten hoe het écht zit, of er ook een echt verband te zien is. Dat blijkt nu bij het hybridisatiemodel niet zo te zijn. Met onze kwantitatieve MO-theorie kennen we steeds meer van de werkelijke causale verbanden en kunnen we dus moleculen gerichter ontwerpen. Dat bespaart een hoop computationele en experimentele trial and error en daarmee ook tijd en geld. En laten we wel wezen: een hoop zaken los je door blindelings uitproberen gewoon nooit op.’
Polymerisatie
Ondanks dat dit een zeer fundamenteel onderwerp is, zijn er ook praktische toepassingen. ‘We hebben een samenwerking met Nouryon, waarin we van dit soort inzichten gebruikmaken om bijvoorbeeld polymerisatie-initiatoren te ontwerpen’, verklaart Bickelhaupt. ‘Ik kan er niet veel over kwijt, maar de fundamentele kennis helpt echt bij het ontwerpproces.’
Het is nog wel even de vraag wanneer dit nieuwe paradigma in de leerboeken terug te vinden is. Bickelhaupt weet bijvoorbeeld dat dit soort onderzoek er wel tien tot twintig jaar over kan doen om zijn weg naar de mainstreamlessen te vinden. Bickelhaupt: ‘Ik vermoed wel dat deze ontdekking iets sneller gaat doordringen, misschien met de volgende editie van een boek over organische chemie. Uiteindelijk diffundeert de nieuwe kennis door tot in de collegezalen.’
Paradigma’s op de schop
De paradigmashift van hybridisatie naar sterische repulsie bij bindingslengtetrends is niet het enige waar de Amsterdamse theoretische chemie-groep mee bezig is. Thomas Hansen, postdoc in de groep van Bickelhaupt, kijkt bijvoorbeeld naar Lewis-zuurkatalysatoren (zie ook de rubriek Grenzen verleggen in deze editie). ‘Katalyse is chemiebreed heel belangrijk, maar om het effectief toe te passen moet je het goed begrijpen’, vertelt Hansen. ‘Als een Lewis-zuur een Diels-Alder-reactie katalyseert, dacht men dat de LUMO (lowest unoccupied molecular orbital) verlaagt zou worden, wat voor een sterkere orbitaalwisselwerking zou zorgen. De LUMO-verlaging treedt weliswaar op, maar de som van orbitaalwisselwerkingen wordt desondanks niet sterker. De eigenlijke reden dat de katalysator de reactie versnelt is dat het de elektronendichtheid op het diënofiel verlaagt, waardoor er een verminderde sterische hindering is.’ Bickelhaupt vult aan: ‘In technische termen: er is minder closed-shell/closed-shell-repulsie omdat de bezette pi-orbitalen van het diënofiel een kleinere amplitude hebben. Dit onderzoek begint ook net aan te slaan in de community.’















Nog geen opmerkingen