Samuel Stupp ontwerpt en ontwikkelt supramoleculaire polymeren voor uiteenlopende toepassingen, variërend van duurzame energieopwekking tot regeneratieve geneeskunde. Maar zijn polymeren zijn vooral beroemd om hun vermogen om muizen met een dwarslaesie weer controle over hun poten te geven. C2W | Mens & Molecule zocht hem op in Chicago.
Vanuit het kantoor van Samuel Stupp, in downtown Chicago, kijk je uit over het Northwestern Memorial Hospital. Een uitzicht dat hem inspireert, want daar kun je echt iets bijdragen aan het dagelijks leven van mensen. Daarvoor combineert hij verschillende wetenschappelijke gebieden en kijkt hij verder dan de chemie. Stupp heeft dan ook een combinatie van leerstoelen; hij is hoogleraar materiaalwetenschappen en -technologie, chemie, geneeskunde én biomedische technologie aan Northwestern University.

Zijn hele onderzoek draait om zelf-assemblerende polymeren. In hun lab op de Northwestern campus in Evanston zoeken Stupp en zijn groep naar nieuwe manieren om ‘schone’ energie op te wekken. Bijvoorbeeld met polymeren die onder invloed van zichtbaar licht waterstof of andere brandstofmoleculen produceren. Of polymeren in robotics applicaties, die licht omzetten in mechanische energie. Maar hier, met het universitaire ziekenhuis in zicht, gaat zijn aandacht uit naar regeneratieve geneeskunde. ‘In het begin van de jaren negentig hadden we een molecuul gemaakt dat, onverwacht, een tweedimensionaal supramoleculair polymeer vormde. Vanaf dat moment lag mijn interesse in het bestuderen van zelf-assemblage en het begrijpen van de manieren waarop moleculen in deze structuren interacties aangaan met elkaar’, vertelt Stupp. ‘Deze moleculen vormen hiërarchische structuren en laten complexe dynamiek zien. Die kenmerken vinden we veel in de natuur, inclusief ons eigen lichaam. Daarom leek het een logische stap om deze gebieden te combineren en ons te richten op regeneratieve geneeskunde.’
Amfifielen
Ongeveer twintig jaar geleden resulteerde dit in de ontwikkeling van zogeheten peptide amfifielen; de moleculen waar Stupp nog steeds aan werkt. Peptide amififielen zijn opgebouwd uit aminozuren en andere biomoleculen zoals lipiden, suikers en nucleïnezuren. ‘Ze zijn zo ontworpen dat ze zelf-assemblage vertonen en bioafbreekbaar zijn’, zegt Stupp. ‘Daarnaast wilden we ook bioactieve signalen opnemen in de grotere structuren, zodat ze interacties konden aangaan met receptoren en op die manier processen in het lichaam beïnvloeden. Zoals de groei van een specifiek weefsel.’ In een waterige omgeving kunnen de peptide amfifielen filamenten vormen; lange strengen met hydrofobe staarten die naar binnen wijzen en bioactieve componenten die juist naar buiten gericht zijn. ‘Maar we kunnen, door de bouwstenen aan te passen, ook andere vormen verkrijgen. Bijvoorbeeld een soort gedraaide linten.’
Toen Stupp en zijn team hun eerste peptide amfifielen hadden gemaakt, begrepen ze eigenlijk nog niet wat er precies gebeurde in die zelf-assemblerende structuren. Maar sindsdien is hun inzicht flink gegroeid. ‘We kunnen nu de moleculen heel precies aanpassen en afstellen om ze geschikt te maken voor regeneratie van heel veel verschillende typen weefsels.’ Bot, kraakbeen, spier, glazuur — met de juiste bioactieve signaalmoleculen kunnen ze al deze weefsels laten groeien. Stupp: ‘We kunnen ze nu zelfs inzetten om de aanmaak van bloedvaten te stimuleren.’
‘Onze moleculen zijn nu ook inzetbaar om de groei van bloedvaten te stimuleren’
Pleister
De eerste stap bij al deze vormen van regeneratie is het maken van de juiste structuur die precies is afgestemd op het te vormen weefsel. Die structuren vormen zich razendsnel; zodra je de peptide amfifielen in contact brengt met water, vormen vezels zich in minder dan een seconde. Om te zorgen dat de vezels oplosbaar zijn in water, kun je ladingen introduceren in de moleculen. ‘Dat zorgt ervoor dat je de moleculen in het lichaam kunt injecteren’, legt Stupp uit. ‘Ons lichaam bevat veel zouten, dus wanneer we de oplossing op precies de juiste plek injecteren ontstaat daar vrijwel direct een hydrogel omdat de aanwezige zouten de repulsie tussen geladen groepen afschermen.’ Het is ook mogelijk om de vorming van een hydrogel te voorkomen door de vezeloplossing te verdunnen. ‘Een paar jaar geleden ontdekten we dat sterk verdunde oplossingen van peptide amfifielen via de bloedbaan toegediend kunnen worden. Als we vervolgens een specifiek moleculair segment toevoegen, kunnen we de juiste locatie in het lichaam ‘targeten’. Bijvoorbeeld voor gerichte afgifte van een geneesmiddel of om een soort hydrogel-pleister te vormen om interne bloedingen te stelpen.’
Ruggenmerg
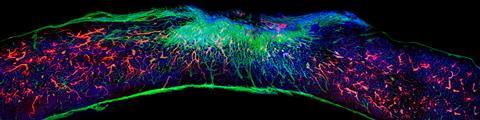
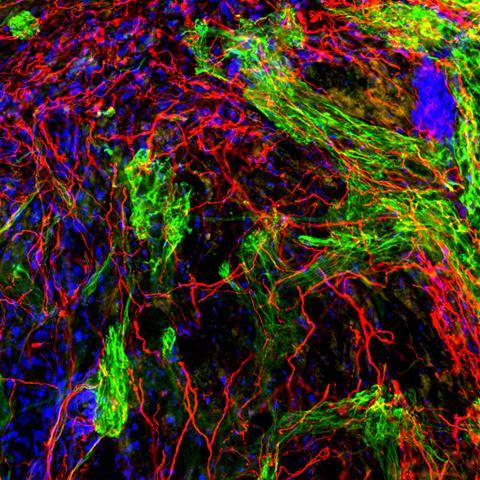
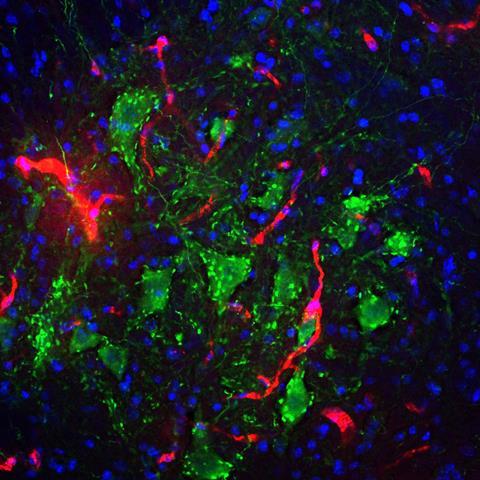
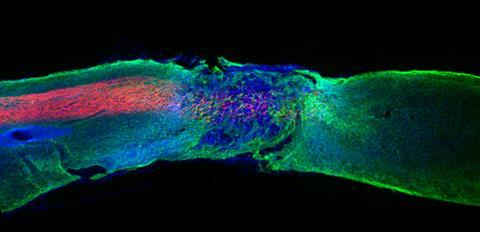
Een van de meeste spannende vondsten was de ontdekking dat de amfifielen ook inzetbaar zijn om schade aan het ruggenmerg, bijvoorbeeld een dwarslaesie, te herstellen. ‘We injecteerden speciaal voor regeneratie ontworpen peptide amfifielen in het zwaar beschadigde ruggenmerg van muizen’, vertelt Stupp. ‘Na twaalf weken zagen we dat de muizen weer controle kregen over hun achterpoten en ze konden bewegen. Dat was geweldig om te zien.’ Onlangs stuitte het team op een belangrijk, nieuw inzicht, namelijk dat de dynamiek van de moleculen in de grotere structuur een cruciale rol speelt in de waargenomen regeneratie. ‘De receptoren op cellen zijn constant in beweging’, zegt Stupp. ‘Om de kans te vergroten dat onze biosignalen en de receptoren bij elkaar komen, moet ons systeem dus ook beweeglijk zijn. Daarom hebben we onze peptide amfifielen zo ontworpen dat ze op een dynamische manier onderdeel zijn van de vezels.’
De sleutel hiervoor bleek te liggen bij de gebruikte aminozuren. Door een andere samenstelling werden de onderlinge interacties zwakker, waardoor het gehele systeem veel dynamischer werd. Stupp: ‘Individuele amfifielen kunnen zich nu over het vezeloppervlak verplaatsen en zich binnen de vezels bewegen. Ze kunnen soms zelfs even uit de grotere structuur ‘springen’ en dan weer terugkeren naar een filament.’ Door deze dynamische eigenschappen lijken de moleculen te dansen en dat blijkt een enorm positief effect te hebben op het regeneratieve effect. ‘Met het dynamische systeem zagen we veel meer groei van axonen [de uitlopers van zenuwcellen, red], regeneratie van bloedvaten en nog andere verbeteringen’, vertelt hij enthousiast. ‘Dit zorgt voor significant betere beweging in de muizen na slechts vier weken. Ik zeg dit niet vaak, maar dit voelde als een echte doorbraak.’
’Vanaf dat moment lag mijn interesse in het bestuderen van zelf-assemblage’
Motiverend
Met deze nieuwe inzichten en het werkende platform is het tijd voor de volgende stap: de klinische ontwikkeling. Het is niet te voorspellen of deze positieve resultaten ook in mensen worden behaald, maar toch is Stupp optimistisch. ‘Ik heb goede hoop dat het ook in mensen kan werken. Maar er zijn natuurlijk nog heel wat obstakels. In de muizen konden we binnen 24 uur na de schade onze moleculen toedienen. We weten daarom nog niet of onze materialen ook werken bij meer chronische schade.’
Vanuit wetenschappelijk oogpunt zijn er ook nog veel open vragen. ‘Ik wil supramoleculaire structuren en hun onderliggende mechanismen zo grondig mogelijk begrijpen, maar daarvoor moeten we nog veel meer moleculen ontwikkelen en systemen testen.’ Stupp wordt vaak gevraagd als spreker op patiëntbijeenkomsten over verlamming en dwarslaesies. Dat motiveert hem enorm. ‘Deze mensen hebben het moeilijk. Ik wil hen zoveel mogelijk helpen en daarom zal ik hiermee doorgaan tot het is gelukt.’




















Nog geen opmerkingen