Vuur is – net als water – een van die natuurkrachten die tot onze verbeelding spreekt en zowel nuttige en goede als destructieve en gevaarlijke eigenschappen heeft. Met een kampvuur houd je jezelf warm, zorg je voor licht en bereid je eten in het wild. Maar als diezelfde vonken op een droog grasveld of bos overspringen, ontstaan bosbranden die allesverwoestend zijn. Maar wat is vuur eigenlijk precies? Hoe werken vlammen? Wat geeft vlammen hun kleur? Hoe kun je zorgen dat dingen niet te snel vlamvatten? En wat kun je eigenlijk allemaal met vuur?
Vlammen
Wanneer je iets verbrandt, vormen zich gassen: de vlam. De brandstof bepaalt hoe die vlam eruitziet en welke kleur en temperatuur die heeft. Neem een kaars. Wanneer je een kaars aansteekt met een lucifer, verdampt die eerste vlam een beetje kaarsvet. Het gasvormige kaarsvet kan vervolgens makkelijker met zuurstof reageren, waarbij allerlei verschillende gassen en microdeeltjes vrijkomen. Sommige van die gassen worden zo heet dat ze geëxciteerd raken, dat wil zeggen dat elektronen energie opnemen. Wanneer ze afkoelen, vallen de elektronen terug en produceren ze straling in de vorm van licht. Dat is een van de onderdelen van de zichtbare vlam.
Maar een vlam bevat meer informatie. Verschillende materialen geven namelijk verschillende soorten vlamkleuren en -temperaturen. Dat komt omdat elke stof een andere set elektronen heeft die een bepaalde hoeveelheid energie kan opnemen. De gecombineerde straling die vrijkomt bij het terugvallen van die elektronen noem je het emissiespectrum, wat je soms kunt gebruiken in een vlamproef om bijvoorbeeld vast te stellen wat voor metaal er in een sample zit. Niet alleen is dat interessant, je krijgt vaak ook prachtige kleuren en dat gebruiken pyrotechnici weer om siervuurwerk te maken.
Iets anders dat je aan vlammen kunt meten is de temperatuur. Belangrijk om hierbij te vermelden is dat de kleur van de vlam niet zozeer aangeeft hoe heet die is. De temperatuur wordt bepaald door factoren als druk, zuurstofgehalte in de atmosfeer, de brandstof en de afstand tot de bron van de vlam. Afhankelijk van hoe ver je de zuurstoftoevoer van een bunsenbrander openzet kan de vlam 900 tot 1600°C zijn. De maximale temperatuur van een houtvuurtje (1027 °C) is vergelijkbaar met de gemiddelde temperatuur van een kaars (1100°C). Maar het officiële wereldrecord voor heetste vlam op aarde staat op naam van dicyanoacetyleen : bijna 5000°C. Dat is bijna even heet als het zonoppervlak (5500°C).

Heetste vlammen
Bunsenbrander (weinig zuurstof, 900°C) – kampvuur (1027°C) – kaars (1100°C) – bunsenbrander (veel zuurstof, 1600°C) – dicyanoacetyleen (zie hieronder, 4987°C) – zonoppervlak (5000°C)
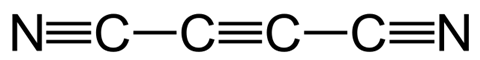
Vuur maken

Lucifer: Waar vroeger alle ingrediënten in de luciferkop zaten, zijn die nu deels gescheiden. In de kop zit antimoonsulfide, een oxidator als kaliumchloraat en zwavel of houtskool. Aan de zijkant van het luciferdoosje zit het andere ingrediënt: rode fosfor. Bij het wrijven van de luciferkop tegen het ruwe oppervlak met fosfor ontstaat wrijvingswarmte die genoeg energie geeft om de oxidatiereactie te beginnen, wat resulteert in vuur.
Tondeldoos: Bevat drie onderdelen: het tondel (vast ontvlambaar materiaal), een vuursteen (flint) en een vuurijzer. Door met flint over vuurijzer te schrapen komen er miniscule ijzerdeeltjes van af die spontaan met zuurstof reageren tot vonken en hitte, wat de tondel aan kan steken.
Vuurpomp: Een holle cilinder die aan een kant dicht is met een losse zuiger die perfect aansluit zodat je de lucht in de cilinder kunt samenpersen. Onder in de cilinder is een kleine ruimte waar je tondel kunt plaatsen. Samenpersen van de lucht kan de temperatuur in de cilinder kort boven de 260°C laten komen wat overeenkomt met de ontledingstemperatuur van tondel. De tondel kan daardoor veranderen in sintel, wat kan dienen als basis voor een groter vuur.
Blussen
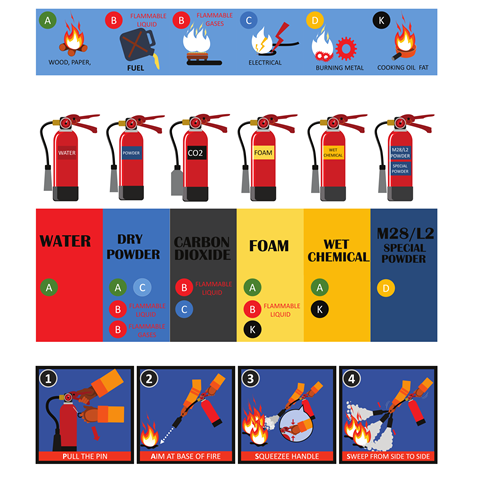
Om een vuur te doven of te blussen moet je simpel gezegd een van de drie zijdes van de vuurdriehoek verwijderen: haal je de zuurstof weg, dan heb je geen oxidator meer die reageert met de brandstof. Andersom is het weghalen van de brandstof – of ervoor zorgen dat een brand niet bij meer brandstof kan komen – ook een effectieve manier om vuur te doven. En ook als je de hittebron weghaalt, kan een vuur niet blijven bestaan.
Blussen lijkt dus relatief simpel, maar toch is oplettendheid geboden. Een verkeerde blusmethode kan de brand namelijk alleen maar erger maken. Als bijvoorbeeld de vlam in de pan slaat, dan is het een slecht idee om met water te blussen (hittebron weghalen). Bij de vlam in de pan is de brandstof namelijk olie of vet, wat niet met water mengt. Gooi je er dan water overheen, dan verplaatst de olie zich over de rand van de pan en verspreidt het vuur zich. Je kunt het vuur dus beter doven door een deksel op de pan te doen: dat ontneemt de brand zijn zuurstof. Zet ook het gas uit en haal de pan van de warmtebron.
Een vergelijkbare methode als de deksel op een pan doen is de blusdeken: dat zijn vuurvaste dekens die je over een brandend voorwerp legt om zo de zuurstoftoevoer te verwijderen. Brandjes kun je ook blussen met poederblussers, schuimblussers of kooldioxideblussers.
Vlamvertragers
Voorkomen is beter dan genezen, luidt het gezegde. Daarom bieden vlamvertragers een effectieve – doch ietwat controversiële – optie tegen het ontstaan van brand. Vlamvertragers zijn chemische stoffen die zorgen dat materialen minder snel vlamvatten. Ze zitten in tal van alledaagse producten, zoals matrassen, vloerkleden, computers, elektrische kabels, en auto- en treinonderdelen, om maar wat te noemen. Dat ze zo goed tegen brand helpen, komt door de moleculaire structuur. Je hebt honderden soorten, verdeeld in klasses als gebromineerde vlamvertragers, polygebromeerde difenylethers (PBDE’s), tetrabromobisfenol A (TBBPA), hexabromocyclododecaan (HBCD) en organofosfaat-vlamvertragers. Ook bestaan er natuurlijke vlamvertragers, zoals asbest, een vezelachtig mineraal van silicaten, dat tot een paar decennia geleden als isolatiemateriaal werd gebruikt.
Er zijn meerdere manieren waarop vlamvertragers werken. Sommige starten bij het ontbranden een endotherme reactie, waardoor het materiaal afkoelt . Anderen zorgen voor een soort isolerende laag tussen het brandende materiaal en de nog onaangetaste delen. Bij het ontbranden van weer andere vlamvertragers ontstaan inerte gassen zoals koolstofdioxide en water die de zuurstof uit de omgeving verdrijven. Bij vlamvertragers met halogenen ontstaan bij ontbranding halogeenradicalen die veel minder reactief zijn dan waterstof- of hydroxideradicalen die bij andere materialen vrijkomen. Die radicalen helpen normaal gesproken bij de oxidatieve ontbrandingsreacties, maar de halogenen vertragen dat proces dus.
Ondanks de goede werking van vlamvertragers is er ook een probleem: gezondheid. Asbest is in dat opzicht berucht. Als je dat in stukken zaagt of erin boort, komt er stof vrij. Adem je dat in, dan veroorzaakt dat een bijzondere en dodelijke kanker in het weefsel van je longen. Ook het materiaal dat vrijkomt van vlamvertragers is slecht voor mens en milieu. Daarom zijn er ook al veel vlamvertragers verboden en uit productie gehaald. Vlamvertragers zijn persistente stoffen, wat wil zeggen dat ze lang in het milieu blijven zonder af te breken, en bio-accumulatief, wat betekent dat ze in mensen- en dierenorganen ophopen. Ze kunnen zo onder andere kanker veroorzaken, maar ook leiden tot problemen met het immuunsysteem, de vruchtbaarheid verminderen of bij zwangere vrouwen een gevaar vormen voor het ongeboren kind.
Flogiston

In de zeventiende eeuw kwam de Duitse natuurkundige en alchemist Johann Joachim Becher met een theorie over vuur op de proppen. Becher bedacht dat er drie vormen van aarde bestonden: terra lapidea, terra fluida en terra pinguis. Die laatste zou dan een speciale substantie zijn die in brandbaar materiaal voor zou komen.
Zijn student Georg Ernst Stahl nam dit idee over en ontwikkelde het tot een ware theorie: de flogiston-theorie. De theorie stelde dat flogiston – Grieks voor ‘ontbranding’ – een element was dat vrijkwam bij verbranding. Je kon de substantie niet in een flesje doen, maar het was wel overdraagbaar van het ene op het andere materiaal. Ondanks dat het tegenwoordig als een raar idee klinkt, had de theorie tot op zekere hoogte een goed uitleggend vermogen.
Als je bijvoorbeeld een stuk hout verbrandt, blijft er een hoopje as over dat veel minder zwaar is dan het stuk hout. Er moet dus iets zijn verdwenen uit het stuk hout: flogiston. De as die overblijft is dan eigenlijk de essentie van het hout. Sommige voorwerpen zoals stenen hebben heel weinig flogiston (vandaar dat het niet brandt), terwijl andere dingen zoals stro juist bijna compleet uit flogiston lijken te bestaan omdat er zo goed als niks overblijft.
Ook andere observaties werden zo verklaard: het verbranden van metaal levert je een poeder op – calx genoemd – en als je dat weer verhit met een flogiston-rijke brandstof als kolen dan bindt de flogiston uit de kolen met het metaal en ontstaat er ‘gedeflogisticeerde lucht’. Flogiston kon alleen niet álles verklaren…

Sommige metalen worden namelijk zwaarder als je ze verbrandt, en dat klopt niet als flogiston een substantie is die uit het metaal zou moeten verdwijnen. Sommige voorstanders van flogiston meenden dat flogiston een negatief gewicht had, anderen dachten dat het lichter was dan lucht. Helaas voor hen leverde dit geen goede oplossing op.
De Franse chemicus Antoine-Laurent de Lavoisier begon sceptisch te worden, mede door de ‘absurde’ verklaringen van zijn tijdgenoten. De Lavoisier kwam daarom met een nieuwe theorie: de zuurstoftheorie. De Franse chemicus stelde in die theorie dat ‘gedeflogisticeerde lucht’ zelf verantwoordelijk was voor ontbranding en dat flogiston helemaal niet bestond. Hij liet zien dat ontbranding een gas nodig had dat gewicht had (zuurstof), wat je kunt meten met gesloten vaatjes. De flogiston-voorstanders wilden hun idee verdedigen, maar deden daarvoor steeds meer (onterechte) aannames. Ondanks de koppigheid van de flogiston-voorstanders, was de flogiston-theorie niet meer te houden en wonnen De Lavoisier en zijn medestanders met hun ‘antiflogiston’-theorie steeds meer terrein.
Faradays kaarslezingen
‘Ik zal u in vijf lezingen de chemische geschiedenis van een kaars vertellen. Er is geen wet in het universum die niet in de scheikunde van een kaars aan de orde komt. Er is geen betere, geen opener deur waardoor men de studie der wetenschap kan binnentreden, dan door de natuurkundige verschijnselen van een kaars te beschouwen. Ik vertrouw er dan ook op dat ik u niet zal teleurstellen door dit als onderwerp te kiezen in plaats van een nieuwer onderwerp, dat niet beter zou kunnen zijn, al was het nog zo goed.’ Zo begint Michael Faraday zijn lezingen over de natuurkundige en chemische verschijnselen van een kaars, die hij rond 1860 gaf. In zijn derde versie van de serie zaten wel zevenhonderd mensen in de zaal (zie foto). Later schreef iemand die de lezingen had bijgewoond over Faradays ‘zilverachtige haar’, zijn ‘ernstige gezicht’, en zijn ‘onweerstaanbare welsprekendheid, die de aandacht trok.’

















1 Opmerking van een lezer